La terapia
La terapia genica della HLH familiare (fHLH) è la nuova frontiera della medicina moderna che promette di rivoluzionare i protocolli di cura per una risoluzione rapida e definitiva della malattia. L’evoluzione in questo campo è veloce e nonostante i risultati positivi ottenuti in sistemi in vitro, la traslazione di questa terapia nella clinica è ancora agli albori.
Lentivirus modificati sono stati utilizzati con successo per trattare modelli animali sperimentali affetti da FHL2 (mutazioni nel gene, PRF1) (1,2) o da FHL3 (mutazioni nel gene UNC13D), di cui ho parlato in dettaglio in un AILE blog del 2021 (3). L’uso terapico dei virus pone però numerosi problemi di biosicurezza legati alla natura virale che da un lato permette loro di integrarsi nel genoma ospite con un’alta efficienza, e quindi offre la possibilità di correzione del difetto genico, ma d’altro canto crea rischi di attivazioni geniche incontrollate.
La svolta
La svolta epocale nel campo della terapia genica è arrivata recentemente con l’utilizzo di approcci di ingegneria genomica che superano i limiti legati alla produzione di stock di “virus medicali” e a rischi, seppur minimi, di mutazioni non volute. L’uso di particolari enzimi batterici detti nucleasi permette di intervenire in maniera precisa per trovare e correggere gli errori genetici nel DNA anche a livello di una singola lettera.
L’editing del genoma è una tecnica davvero rivoluzionaria che promette una medicina di precisione. La tecnologia basata su due nucleasi dette TALEN o CRISP-CAS9, per esempio, è stata utilizzata come -proof of principle- in un modello animale da laboratorio FHL3 (4 e AILE blog 2022), dimostrandosi efficace e sicura nel ripristinare un sistema immunitario funzionale nel topo malato. Uno dei ricercatori coinvolto nel progetto di terapia genica per la UNC13D (4), Toni Cathomen, oggi Professore e Direttore dell’Istituto di Medicina Trasfusionale e Terapia Genica presso il Medical Center dell’Università di Friburgo, aggiunge nuovi risultati nel campo della terapia genica pubblicando un articolo sulla rivista J. Allergy. Clin. Immunol. (5). La ricerca rende conto di una nuova strategia curativa di terapia genica applicabile all’uomo e che è stata dapprima provata nel modello murino per la FHL3 chiamato Jinx 4.
L’animale esprime una mutazione indotta nel gene UNC13D che provoca la sintesi di una proteina MUNC 13-4 più piccola e non funzionante rispetto al topo normale. Di conseguenza, nel caso di infezione virale, la degranulazione citotossica dei linfociti T nel topo Jinx 4 è assente e l’animale esprime, in maniera del tutto sovrapponibile, le manifestazioni cliniche dei pazienti HLH.
Nel dettaglio
Il protocollo di cura mediante editing genomico messo in atto dal gruppo di ricercatori tedeschi e pubblicato in dettaglio nell’articolo scientifico, ha lo scopo di dimostrare che la terapia genica può essere efficace e risolutiva per la FHL3 nell’uomo.
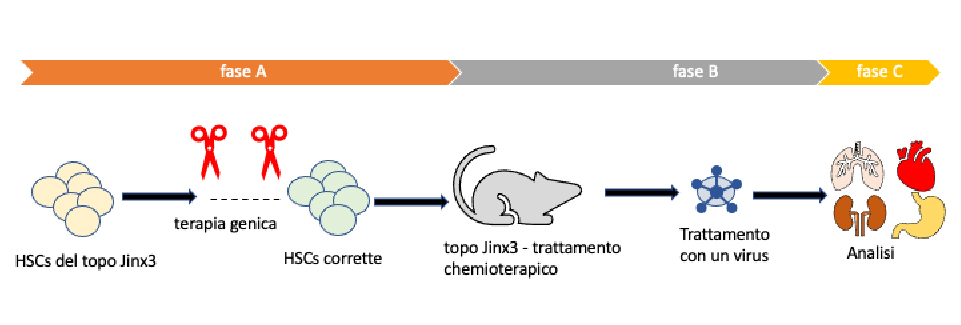
Per raggiungere l’obiettivo, i ricercatori hanno isolato e corretto in vitro, la mutazione nel gene UNC13D nelle cellule staminali ematopoietiche (HSC) del topo Jinx4, attraverso la tecnologia CRISPR /Cas9 (figura, fase A). Hanno utilizzato un regime di condizionamento con una dose bassa di un chemioterapico (busulfan) per sopprimere il sistema immunitario difettoso del topo. Quest’ultimo è stato poi rigenerato dalle HSC modificate con l’editing genomico e trapiantate nuovamente nel topo Jinx4. Infine i topi trapiantati sono stati esposti una seconda volta ad un virus (figura, fase B) per valutare l’efficacia del trattamento di ingegneria genomica (figura, fase C). Con questo approccio, gli investigatori hanno voluto allineare la successione sperimentale nel modello murino con la potenziale situazione clinica nell’uomo, per valutare al meglio gli aspetti positivi e illuminando le eventuali criticità.
I risultati
I risultati riportati nell’articolo mostrano che la correzione genetica in vitro delle HSC e il loro successivo trapianto ripristina la funzionalità del sistema immunitario del topo Jinx come stimato dalla riacquistata capacità citotossica dopo una esposizione virale. Il rischio di sviluppare danni mutageni al DNA in seguito al condizionamento con agenti alchilanti o lo sviluppo di tumori è stato ampiamente valutato: nessun segno di espansione clonale delle cellule T né di genotossicità (prerequisito per lo sviluppo di leucemie) è stato individuato nei topi trattati. Questo studio fornisce perciò importanti prove precliniche dell’efficacia e della sicurezza dell’editing genetico delle HSC nel trattamento dei pazienti in vivo.
FHL3 rappresenta il secondo più frequente tipo di fHLH e quindi riveste un interesse specifico come potenziale target per la terapia genica.
Rimane aperta una questione di cruciale importanza nell’uso delle tecniche di ingegneria genomica: l’off target cioè, le modifiche genetiche non specifiche e non intenzionali che possono verificarsi attraverso l’uso di tecnologie che usano le nucleasi ingegnerizzate. In questo articolo, gli autori hanno valutato la presenza di queste modifiche solo nelle HSC ingegnerizzate. Nel recente congresso dell’Histiocyte Society Americana ad Atene 2023, lo stesso Prof Cathomen ha presentato nuovi dati al tal proposito, indicando che l’effetto off target è dipendente dal tipo nucleasi usata ed è generalmente basso nelle HSC modificate ma non in altri tessuti. Questo significa che per i ricercatori impegnati in terapie geniche c’è l’urgenza di scandagliare molti tessuti per una valutazione effettiva delle modifiche genetiche indotte dal trattamento.
Possibilità future
Attualmente la cura della HLH prevede sostanzialmente due fasi. 1) il controllo dell’iperinfiammazione e 2) la sostituzione del sistema immunitario difettoso.
Per la prima fase si usa la chemioterapia basata sull’uso dell’etoposide, in un protocollo standardizzato (HLH-94) (6). Alternative sono l’immunoterapia con un anticorpo anti-globulina timocitica, ma risultati promettenti sono stati raggiunti con l’uso dell’anticorpo monoclonale anti-CD52 alemtuzumab (7). Con questi regimi, il tasso di sopravvivenza dei pazienti con FHL prima del trapianto di cellule staminali ematopoietiche (HSC) varia dall’80% al 95%.
La seconda fase del trattamento si ottiene tipicamente mediante il trapianto di HSC dopo una fase di condizionamento per la soppressione del sistema immunitario dell’ospite. Recentemente, è stata riportata una sopravvivenza post-trapianto fino al 100% con condizioni di condizionamento a ridotta intensità (8). Tuttavia, la disponibilità limitata di donatori abbinati, le tossicità legate al condizionamento e il rigetto dopo il trapianto rimangono sfide importanti durante il trattamento di fase 2, che richiedono nuovi approcci terapeutici.
Basandoci sulle reali potenzialità offerte dalle tecnologie di editing genomico, auspichiamo un ulteriore sviluppo di queste metodologie basate sulle modifiche in vitro delle HSC per curare definitivamente l’HLH negli esseri umani. Le preoccupazioni legate alla sicurezza sono al vaglio sia negli Stati Uniti sia in l’Europa, dove le autorità di regolamentazione monitorano attentamente la sicurezza dei farmaci basati su CRISPR destinati all’uso umano, e dove sono in corso implementazioni rigorose di test standard che siano validi in tutto al mondo.
Bibliografia
- Carmo M, Risma KA, Arumugam P, Tiwari S, Hontz AE, Montiel-Equihua CA, et al. Perforin gene transfer into hematopoietic stem cells improves immune dysregulation in murine models of perforin deficiency. Mol Ther 2015;23: 737-45.
- Ghosh S, Carmo M, Calero-Garcia M, Ricciardelli I, Bustamante Ogando JC, Blundell MP, et al. T-cell gene therapy for perforin deficiency corrects cytotoxicity defects and prevents hemophagocytic lymphohistiocytosis manifestations. J Allergy Clin Immunol 2018; 142:904-13.e3.
- Takushi, Sarah E et al. “Lentiviral Gene Therapy for Familial Hemophagocytic Lymphohistiocytosis Type 3, Caused by UNC13D Genetic Defects.” Human gene therapy 2020 : 31, 626-638. (Blog 2021)
- Houghton BC, Panchal N, Haas SA, Chmielewski KO, Hildenbeutel M, Whittaker T, Mussolino C, Cathomen T, Thrasher AJ, Booth C. Genome Editing With TALEN, CRISPR-Cas9 and CRISPR-Cas12a in Combination with AAV6 Homology Donor Restores T Cell Function for XLP. Front Genome Ed. 2022 May 23;4:828489. (Blog 2022)
- Dettmer-Monaco V, Weißert K, Ammann S, Monaco G, Lei L, Gräßel L, Rhiel M, Rositzka J, Kaufmann MM, Geiger K, Andrieux G, Lao J, Thoulass G, Schell C, Boerries M, Illert AL, Cornu TI, Ehl S, Aichele P, Cathomen T. Gene editing of hematopoietic stem cells restores T-cell response in familial hemophagocytic lymphohistiocytosis. J Allergy Clin Immunol. 2023 :S0091-6749(23)00989-2.
- Henter JI, Horne A, Arico M, Egeler RM, Filipovich AH, Imashuku S, et al. HLH- 2004: diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocyto- sis. Pediatr Blood Cancer 2007; 48:124-31.
- Fischer A, Blanche S, Neven B, Elie C, Picard C, de Saint Basile G, et al. Alemtuzumab as first line treatment in children with familial lymphohistiocytosis. Blood 2019;134:80.
- Marsh RA, Vaughn G, Kim MO, Li D, Jodele S, Joshi S, et al. Reduced-intensity conditioning significantly improves survival of patients with hemophagocytic lymphohistiocytosis undergoing allogeneic hematopoietic cell transplantation. Blood 2010;116:5824-31.

