La scoperta
La nuova scoperta parte dalla storia di due fratelli di Amburgo in Germania nati da genitori consanguinei.
Il primo muore a soli due anni di età di HLH a causa di una infezione da citomegalovirus, mentre la sorella viene ricoverata a soli due mesi con una sindrome complessa che comprende distrofia, disfunzioni endocrinologiche e ritardo nello sviluppo.
Analisi approfondite eseguite sul sangue periferico della sorella e in particolare nei linfociti mettono in evidenza un serio difetto funzionale nella degranulazione delle cellule T citotossiche. Questo fa supporre che anche la sorella soffra di HLH. Il sequenziamento target dei geni già noti per essere associati alla HLH non evidenzia però nessuna variante patogenica.
Per raggiungere una diagnosi definitiva medici esperti di alcuni centri pediatrici tedeschi guidati dal dr. Kai Lehmberg (1), decidono di approfondire sequenziando il DNA della bimba in modo più ampio, per identificare varianti in molti altri geni oltre a quelli causativi della HLH noti.
I risultati di questa analisi mettono finalmente in luce una delezione biallelica “in-frame” di circa 30 paia di basi nell’esone 4 di un gene che, in condizioni normali, produce una proteina chiamata MADD (Mitogen-activated protein kinase activating death domain protein). Questa mutazione descritta per la prima volta da Schneeberger et al., (2), riduce la quantità di proteina MADD nelle cellule ed è associata ad una serie di disturbi neurologici, endocrini, esocrini ed ematologici.
A questo punto rimaneva da scoprire come questo deficit potesse essere la causa del difetto di degranulazione nella paziente pediatrica. Evidenze sperimentali precedenti avevano dimostrato che MADD funziona da fattore di scambio di GTP con una proteina chiamata RAB27A la quale è direttamente coinvolta nella degranulazione dei linfociti citotossici, perciò si ipotizzò che tra le due proteine ci fosse un legame biochimico difettoso. I ricercatori hanno perciò confrontato, in vitro, la capacità citotossica delle cellule T della paziente in esame con quella di un paziente mancante della proteina RAB27A. I risultati di questo confronto mostrarono che il grado di compromissione nelle cellule T del paziente con deficit di MADD era simile a quello delle cellule T senza RAB27A. Questo esito supportava l’ipotesi che tra MADD e RAB27A esistesse un’interazione difettosa che poteva essere la causa del deficit funzionale nella degranulazione osservato nella paziente pediatrica.
Per dimostrare l’autenticità dell’interazione difettosa tra la proteina MADD e la RAB27A i ricercatori hanno generato, partendo da cellule Natural Killer (NK), una linea cellulare in cui la proteina “MADD” è stata rimossa (knockout) attraverso la tecnologia CRISPR/Cas9. Utilizzando questa linea cellulare knockout in un test di degranulazione, gli scienziati hanno dimostrato che la mancanza di MADD effettivamente causa una perdita marcata della capacità di degranulazione e della citotossicità delle cellule NK.
Ulteriore conferma della veridicità di questo meccanismo è stata l’identificazione dello stesso tipo di difetto nei linfociti T di un altro paziente con deficit completo della proteina MADD.
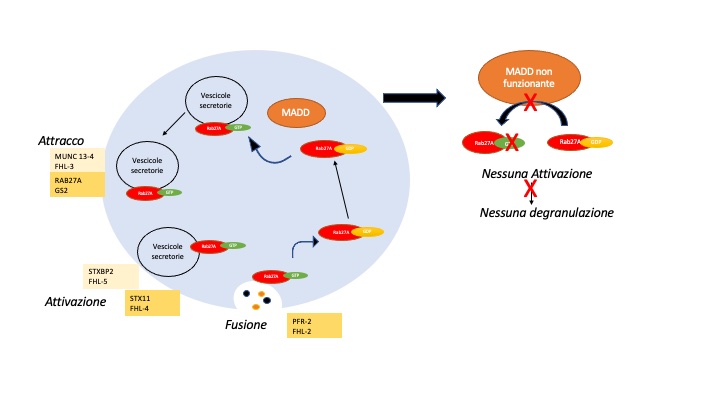
L’interazione difettosa tra due proteine permette di chiarire un meccanismo inedito di regolazione e controllo della funzione di degranulazione. La proteina MADD, dunque, interagisce con RAB27A e facilità il rilascio di vescicole da parte di cellule citotossiche. Il deficit di MADD causa un difetto di degranulazione e rappresenta una nuova malattia che predispone al fenotipo HLH.
In definitiva questo articolo aggiunge un nuovo tassello al complicato meccanismo della citotossicità delle cellule immunitarie e dimostra che MADD svolge un importante ruolo immunologico nell’esocitosi dei granuli citotossici da parte dei linfociti (vedi figura). Il deficit di MADD provoca un disturbo del traffico di vescicole che colpisce vari tipi di cellule e può predisporre alle caratteristiche dell’HLH. Dato che la maggior parte delle forme ereditarie di linfoistiocitosi emofagocitica (HLH) sono causate da difetti di citotossicità, incluso il disturbo del traffico di vescicole (deficit di STXBP2, STX11, PRF-2) la sindrome di Griscelli di tipo 2 (deficit di GS2, RAB27A) anche difetti nella proteina MADD vanno quindi annoverati tra i fattori fisiologici predisponenti all’HLH.
Bibliografia
- Schütze K, Groß M, Cornils K, Wustrau K, Schneppenheim S, Lenhartz H, Korenke GC, Janka G, Ledig S, Müller I, Ehl S, Lehmberg K. MAP kinase activating death domain deficiency is a novel cause of impaired lymphocyte cytotoxicity. Blood Adv. 2023 Apr 25;7(8):1531-1535.
- Schneeberger PE, et al., Maroofian R, Noskova L, Kmoch S, Honzik T, Cope H, Sanchez-Valle A; Undiagnosed Diseases Network; Gelb BD, Kurth I, Hempel M, Kutsche K. Biallelic MADD variants cause a phenotypic spectrum ranging from developmental delay to a multisystem disorder. Brain. 2020 Aug 1;143(8):2437-2453.

